研究学者认为靶向蛋白降解(TPD)技术已成为了彻底改变不可成药靶点的药物发现突破性策略,特别是基于泛素化-蛋白酶体系统的蛋白水解靶向嵌合体(proteolysis-targeting chimera,PROTAC)技术是该领域的代表性策略之一[1]。
然而以往的PROTAC技术受限于有限可用的E3连接酶种类以及蛋白酶体的底物局限性,通过研究学者们不断地创新发展研究,近几年相继涌现出各类新型靶向蛋白质降解技术,如溶酶体靶向嵌合体(lysosometargeting chimera,LYTAC)技术、自噬靶向嵌合体(autophagy-targeting chimera,AUTAC)技术等[2]。
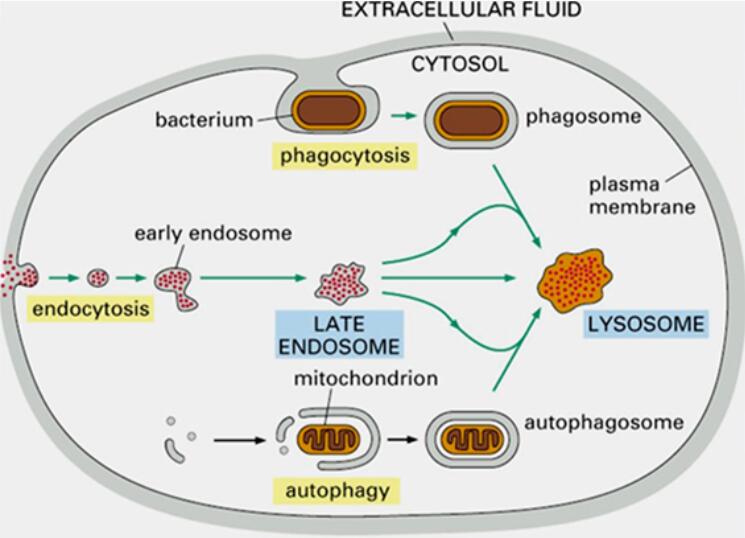
由于靶向蛋白降解(targeted protein degradation,TPD)技术可通过机体自身的蛋白清理系统)去除致病靶蛋白,因而比传统的小分子抑制剂拥有更为广阔的应用领域[3]。在过去的十年里,已有60余种TPD类药物步入了临床实验阶段,共计发起千余起临床试验,近两年的TPD类药物临床试验数量以每年31.5%的速度疯狂增长,足以证明TPD技术的应用性与关注度。
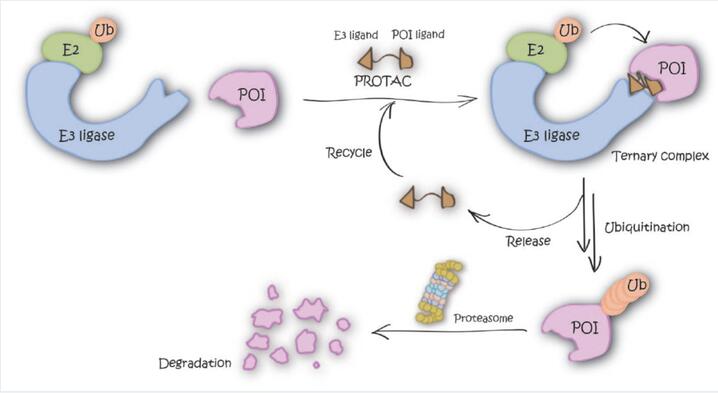
近日,由清华大学生命院与海洋三所研究人员在靶向蛋白降解技术方面合作取得了最新进展,并在Cell Research杂志合作发表了题为An all-in-one targeted protein degradation platform guided by degradation condensates-bridging bi-specific nanobodies的研究工作。这项研究工作利用了一种名为PDF-Bin的全新靶向蛋白降解技术,其创新核心在于利用了一种双特异性纳米抗体,能够同时结合p62蛋白和靶标蛋白,从而将靶蛋白特异性地招募至p62降解凝聚体中,实现了高效的靶向降解。
该技术对多种亚细胞定位和不同流动性的靶蛋白均有降解效果,并且PDF-Bin对不同的靶蛋白选择了最优的降解路径,这一发现为靶向蛋白降解技术的进一步发展和应用提供了新的研究思路。
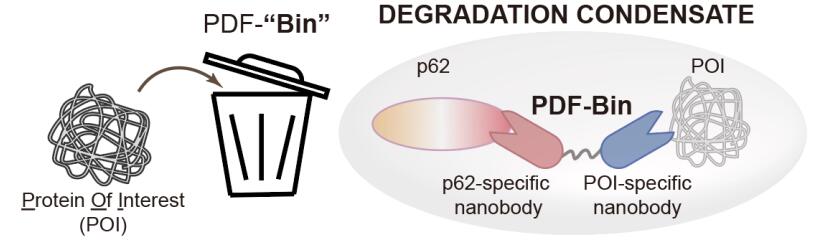
这项研究工作中值得关注的是,此项靶向蛋白降解技术基于双特异性纳米抗体作为靶向策略,相较于传统基于小分子或大分子的靶向策略具有更高的特异性和更强的结合力,极大程度上降低了脱靶风险,为未来TPD药物的研发提供了坚实的基础。
纳米抗体自发现以来,一直以自身分子量小、蛋白稳定性好、亲和力高、特异性强以及强大靶向能力备受科学家的青睐,具有非常广泛的研究和应用前景。
2022年,由斯坦福大学的Laura M.K. Dassama教授和哈佛医学院的Stuart H. Orkin教授联合发表在ACS Cent. Sci.上的文章“A Cell-Permeant Nanobody-Based Degrader That Induces Fetal Hemoglobin”也表明该研究利用纳米抗体来获得具有BCL11A蛋白选择性的蛋白配体。该策略将纳米抗体融合到一个细胞渗透性的微型蛋白和E3适配器上,从而产生一种降解剂,能够在分化的原代红细胞前体细胞中耗尽细胞BCL11A,从而诱导胎儿血红蛋白的表达,此项研究向学者们提供了一种通过对BCL11A进行可逆的、暂时的调节来诱导胎儿血红蛋白表达的方法[4]。
这些研究无一例外的展示了纳米抗体在TPD药物研发领域中强大的应用能力。相信在不久的将来,会出现更多基于纳米抗体的靶向蛋白降解技术的新策略,为TPD药物研究提供更多的研发思路与基础。