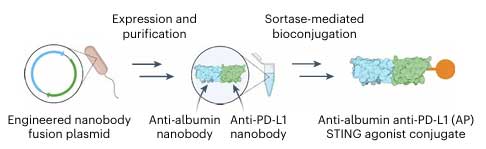
“白蛋白顺风车”策略及双抗纳米抗体的构建
“冷肿瘤”因其免疫原性低、微环境呈免疫抑制状态使得T细胞难以浸润或发挥功能,通常治疗难度较大,需改善免疫微环境或增强免疫应答。STING通路作为连接先天免疫与适应性免疫的关键枢纽,其激动剂可诱导I型干扰素、促炎细胞因子释放,招募NK细胞和T细胞,理论上能将“冷肿瘤”转化为“热肿瘤”。然而,STING激动剂的临床应用受限于三大瓶颈:一是传统给药方式需直接瘤内注射,对深部或转移肿瘤束手无策;二是其作为阴离子小分子药物,药代动力学性质差,现有的激动剂(如环二核苷酸CDNs)在系统给药后会被迅速清除,血液中半衰期不足5分钟,难以在肿瘤部位有效聚集;三是全身给药易引发系统性炎症毒性。如何让STING激动剂精准靶向中立核心并延长其半衰期成为破局关键。
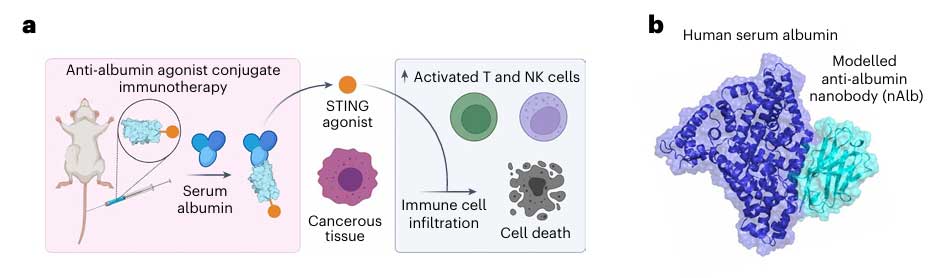
为了延长STING激动剂的半衰期,研究团队将目光投向人体内天然存在的递送蛋白——血清白蛋白。这种蛋白具有惊人的35-40小时循环半衰期,且能自发富集于肿瘤组织。研究人员设计纳米抗体精准结合白蛋白IIIB结构域,并避开新生儿Fc受体结合位点,不影响白蛋白与新生儿Fc受体结合,形成一种抗白蛋白纳米抗体(nAlb),然后通过位点选择性生物偶联化学,将STING激动剂diABZI共价连接至nAlb。结合后的偶联物nAlb-diABZI的半衰期从游离diABZI的90分钟延长至55小时,这种“顺风车”策略不仅延长了药物在体内的存在时间,更利用白蛋白在肿瘤部位的被动蓄积和主动转运,使STING激动剂在肿瘤组织的蓄积量提升约11% ID/g。
抗白蛋白纳米抗体nAlb-diABZI偶联物示意图
为进一步提升肿瘤靶向性并克服免疫抑制,研究团队将nAlb进一步改造为可同时靶向白蛋白和PD-L1的双抗纳米抗体AP-nAlb。这种纳米抗体具有靶向强化以及免疫检查点抑制两大功能。其PD-L1靶向域可与肿瘤细胞及髓系细胞表面的PD-L1结合,使偶联物在肿瘤区域的蓄积量较单靶点nAlb提升约2倍,另外,它可以直接抑制PD-1和PD-L1的相互作用,解除T细胞的抑制信号,与STING激动剂形成协同效应。
双抗纳米抗体AP-nAlb的克隆、表达及生物偶联方案示意图
体外活性:多技术联用验证 STING 通路激活
为了验证纳米抗体偶联物的活性,研究团队选用了THP1-Dual和A549-Dual细胞系对nAlb-diABZI以及AP-diABZI激活STING信号通路的能力进行了全面评估。
在基因表达检测实验中,研究团队将两个纳米抗体偶联物作用于上述细胞系后,提取细胞总RNA并反转录为cDNA,通过qRT-PCR扩增IFN-β和CXCL10基因的特定片段,依据扩增曲线的Ct值,结合标准曲线,精确计算出这些基因在不同处理组中的相对表达量。结果显示,相较于对照组,偶联物处理组的IFN-β和CXCL10基因表达显著上调,证明STING通路被有效激活。
为了进一步确认,研究人员使用ELISA检测从蛋白质层面验证了二者对STING通路的激活情况,而实验结果与qRT-PCR检测基因表达的结果一致,进一步证实了纳米抗体偶联物能够诱导细胞产生并分泌IFNβ和CXCL10蛋白,从而激活STING通路。
尽管nAlb-diABZI的体外活性因纳米抗体偶联略有降低,但深入的机制研究发现,其进入细胞后可通过溶酶体降解释放活性形式。为验证这一过程,研究团队利用荧光标记技术,将荧光基团连接到nAlb-diABZI上,通过共聚焦显微镜观察其在细胞内的摄取与分布。结果显示,标记的nAlb-diABZI被细胞摄取后,主要定位于溶酶体区域。同时,采用Western blot技术检测溶酶体相关蛋白及STING通路关键蛋白的表达与修饰情况。在小鼠骨髓来源巨噬细胞(BMDMs)中,给予nAlb-diABZI处理后,通过Western blot检测到Ifnb1、Tnf等基因对应的蛋白表达显著上调,进一步证实了偶联物在细胞内的活性释放及对STING通路的激活作用。
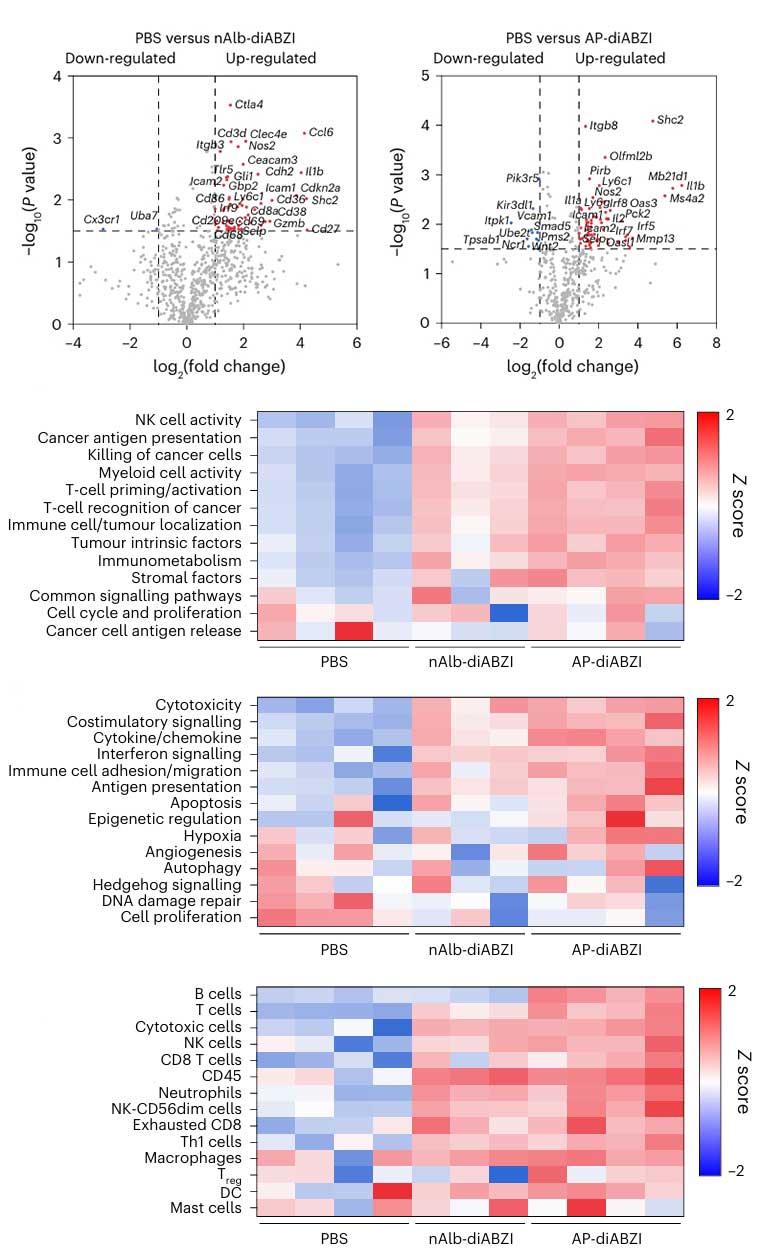
肿瘤组织中 STING 激活的基因表达特征
体内疗效:多模型验证肿瘤生长抑制与免疫微环境重塑
在体内疗效研究方面,研究团队选用了EMT6乳腺癌和B16.F10黑色素瘤小鼠模型,分别对两个纳米抗体偶联物进行了肿瘤生长抑制实验、免疫细胞浸润与功能分析及免疫记忆形成检测。
肿瘤生长抑制实验:在EMT6乳腺癌小鼠模型中,将小鼠随机分为对照组、游离diABZI组、nAlb-diABZI组等多个处理组。采用瘤内注射或尾静脉注射等方式给予相应药物处理。定期使用游标卡尺测量肿瘤的长径和短径,根据公式计算肿瘤体积。实验结果表明,nAlb-diABZI治疗组肿瘤体积较对照组明显减少,在实验周期内,肿瘤体积增长速度显著放缓,至实验终点时,nAlb-diABZI治疗组肿瘤体积较对照组减少约60% 。在B16.F10黑色素瘤小鼠模型中,双价AP-diABZI展现出更为卓越的效果——10只小鼠均出现肿瘤完全消退,完全缓解率达100%。
免疫细胞浸润与功能分析:为探究偶联物对肿瘤微环境中免疫细胞的影响,研究团队将肿瘤组织制备成单细胞悬液,通过表面标志物特异性抗体对不同免疫细胞进行染色。经流式细胞仪检测结果显示,经治疗后,肿瘤微环境中CD8阳性T细胞、NK细胞的数量显著增加,且这些细胞表面的活化标志物表达也明显升高,表明免疫细胞的浸润与活化程度增强。另外,虽伴随MDSCs短暂增加,但通过体内细胞耗竭实验证实,NK细胞和CD8阳性T细胞是抗肿瘤的核心效应细胞。
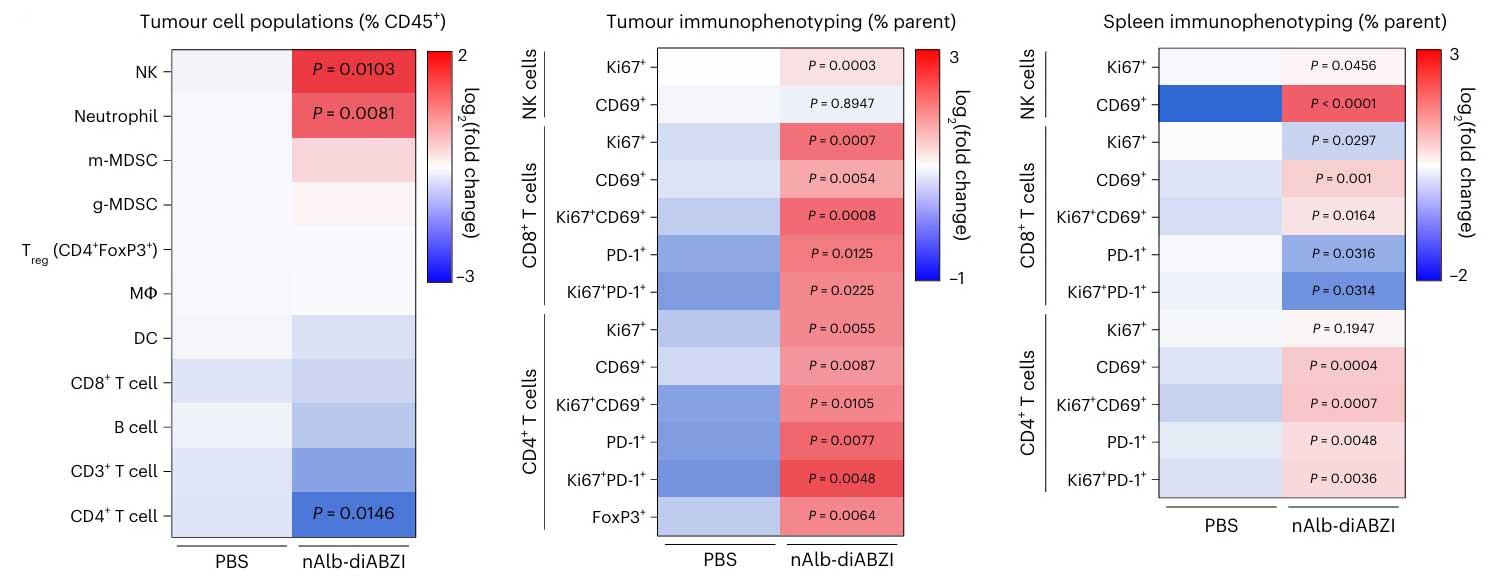
nAlb-diABZI组的肿瘤微环境及脾脏中各细胞激活标志物表达水平
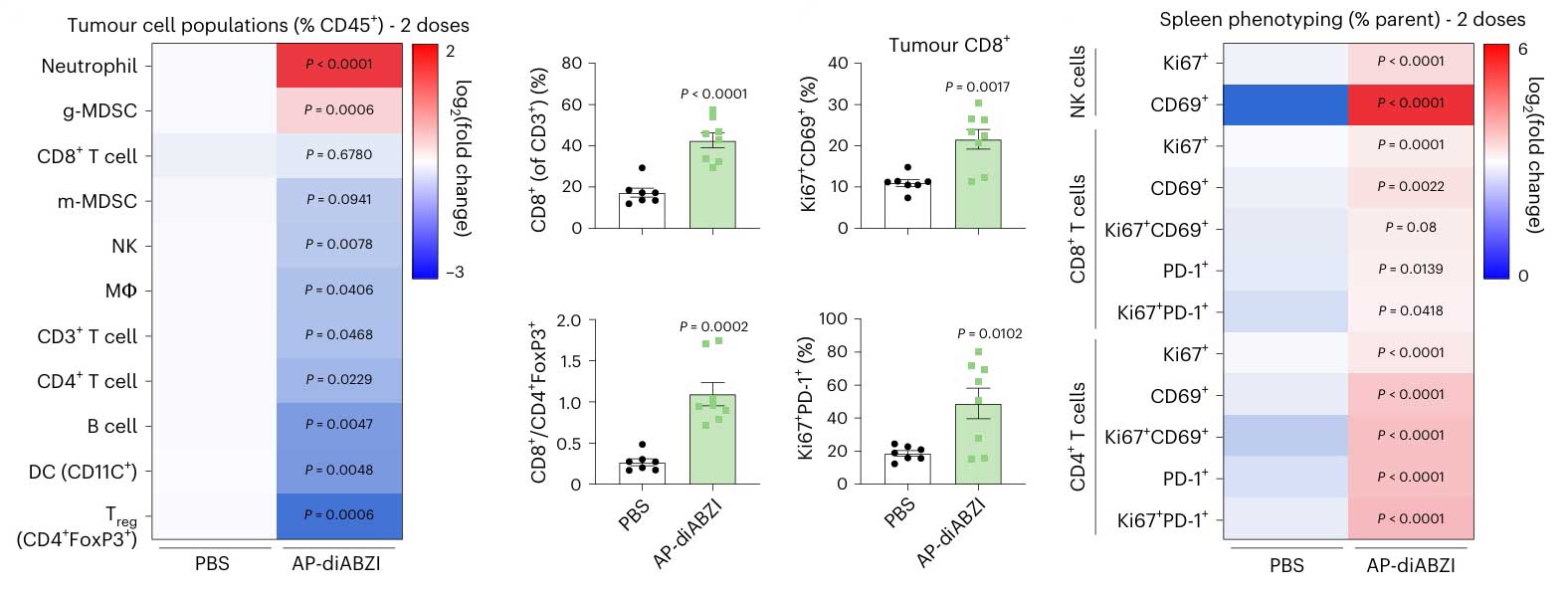
AP-diABZI组的肿瘤微环境及脾脏中各细胞激活标志物表达水平
免疫记忆形成检测:为验证治疗后是否形成免疫记忆,对初次治疗后肿瘤完全缓解的小鼠进行肿瘤rechallenge实验,观察肿瘤生长情况。结果发现,经AP-diABZI治疗后肿瘤完全缓解的小鼠,在再次接种肿瘤细胞后,能够有效抑制肿瘤生长,部分小鼠甚至未出现肿瘤复发,提示长期免疫记忆的建立。这一结果为纳米抗体-STING激动剂偶联物在癌症治疗中的长期疗效提供了有力支持。
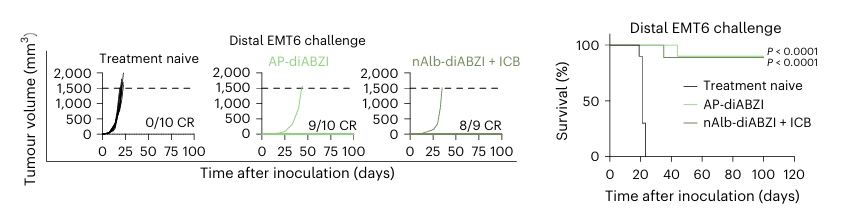
肿瘤免疫记忆形成
安全性:多指标评估确保炎症反应可控
在实验期间,每天观察小鼠的精神状态、饮食、活动等一般情况,并定期测量小鼠体重。结果显示,nAlb-diABZI和AP-diABZI处理组小鼠仅出现短暂的体重小幅下降,且在实验后期体重逐渐恢复。小鼠未表现出明显的精神萎靡、食欲不振、活动减少等异常症状。
为了评估药物对全身炎症反应的影响,研究人员通过ELISA检测了血清中多种细胞因子的水平。结果显示,在给药后特定时间点,血清中IFN-α、IL-12等细胞因子出现一过性升高,但随后逐渐恢复至正常水平,与传统 STING 激动剂引发的持续性、高强度炎症反应相比,纳米抗体偶联物引起的炎症反应更为短暂且可控。
在实验结束后,研究人员对小鼠的主要脏器进行组织病理学检查。将脏器组织固定、切片、染色后,在显微镜下观察组织结构与细胞形态。结果未发现明显的组织损伤、细胞变性或坏死等病理改变,表明 nAlb-diABZI和AP-diABZI对主要脏器无明显毒性。
纳米抗体模块化偶联物策略或可引领免疫治疗未来
与现有STING激动剂递送系统对比,该研究中设计的nAlb-diABZI、AP-diABZI两种纳米抗体偶联物仅在体外活性方面略低于其他递送方式。然而,经过模块化改造后的纳米抗体偶联物在靶向性、半衰期以及渗透性方面均优于其他方式。
正如该研究的第一作者Blaise Kimmel博士所说:“这不仅是STING激动剂的突破,更为各类免疫调节剂提供了‘万能钥匙’”。这项技术的革命性在于其可编程性,通过纳米抗体偶联物的设计可发现该策略适用于其他靶向模块的替换,如应用至HER2、EGFR等靶点。同时,作为“基础平台”,可与ICIs、过继性T细胞治疗联合使用,AP-diABZI预处理可显著增强OT-I T细胞在B16.F10-OVA模型中的抗肿瘤效果,为“STING激动剂+T细胞疗法”提供了新策略。