纳米抗体靶向载体的核心策略
2025年2月,由英国格拉斯哥大学的研究团队在Nature Communications上发表研究,研究表明该团队利用纳米抗体开发了一种纳米抗体-硫酯酶嵌合体,为解决这一难题带来了突破。
纳米抗体因其体积小、稳定性高、亲和力强、易改造性及其能在哺乳动物细胞质中正确折叠而成为理想载体。研究团队提出了一个创新构想:将纳米抗体与负责去除棕榈酰化修饰的硫酯酶融合,构建成嵌合体。而后,纳米抗体就可以将硫酯酶精准地靶向运送并锚定在目标蛋白上,实现局部高浓度的酶活性,从而特异性地去除目标蛋白的棕榈酰化修饰。
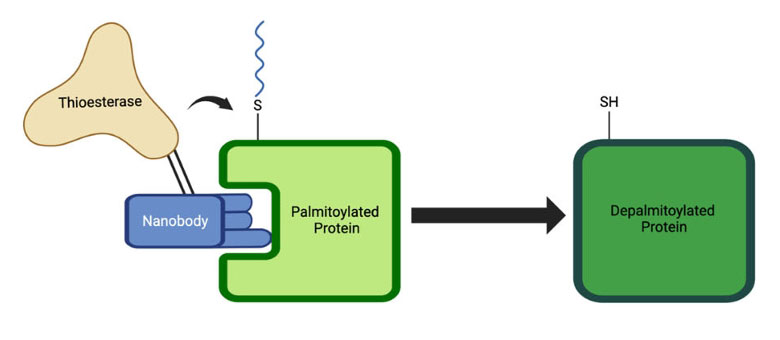
图1:纳米抗体-硫酯酶嵌合体作用机制
构建嵌合体,验证去棕榈酰化活性及靶向规律
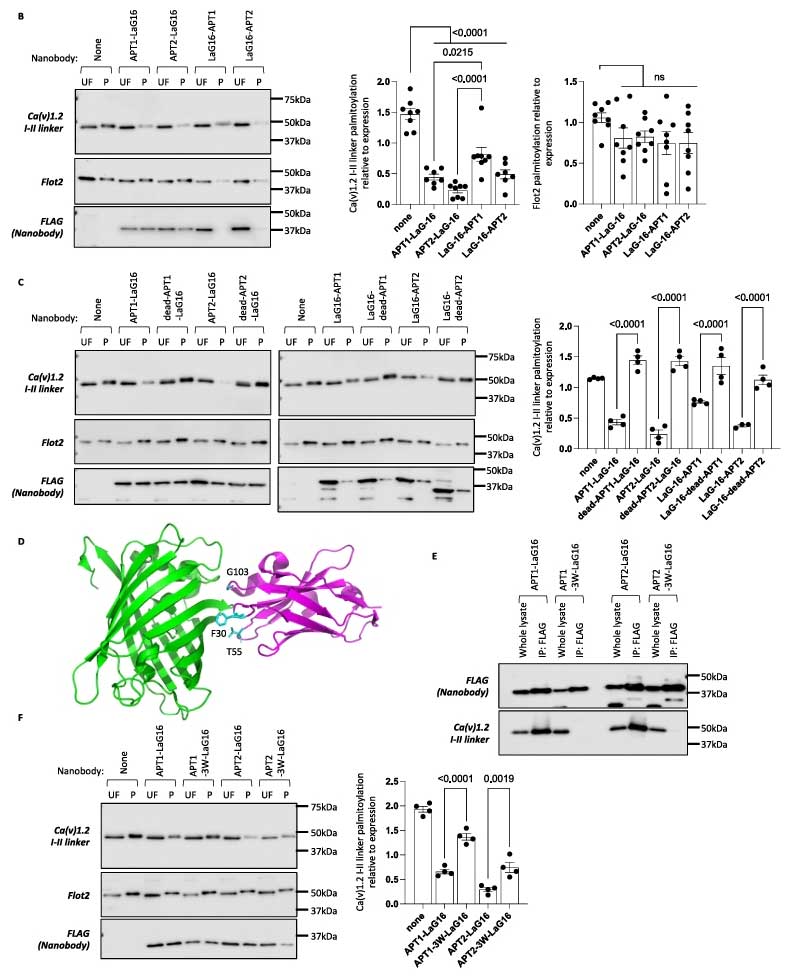
研究团队选择了亲和力极高的抗eGFP纳米抗体LaG-16。将其分别融合到两种主要的去棕榈酰化硫酯酶APT1和APT2的N端或C端,并使用带有YFP标签的心脏钙通道Ca(v)1.2的α亚基内的一段已知被双重棕榈酰化的连接区作为模型底物。将该底物与不同的纳米抗体-硫酯酶融合体共表达在HEK293细胞中,利用树脂辅助捕获技术检测底物的棕榈酰化状态。
验证结果显示,所有四种融合体都能高效去除YFP-α1C-II连接区的棕榈酰化,而对管家蛋白flotillin-2的棕榈酰化没有影响,且C端融合体效果略优于N端融合体;当融合体中的硫酯酶催化位点丝氨酸被突变失活时,去棕榈酰化作用消失;当改造LaG-16使其结合能力降低时,其融合体的去棕榈酰化能力也显著减弱。
结果表明,通过纳米抗体将硫酯酶招募到目标蛋白附近,足以诱导该蛋白的去棕榈酰化,即使该蛋白通常并非该硫酯酶的天然底物。纳米抗体与目标蛋白的结合是实现靶向去棕榈酰化的关键。
图2:靶向蛋白质棕榈酰化的纳米抗体
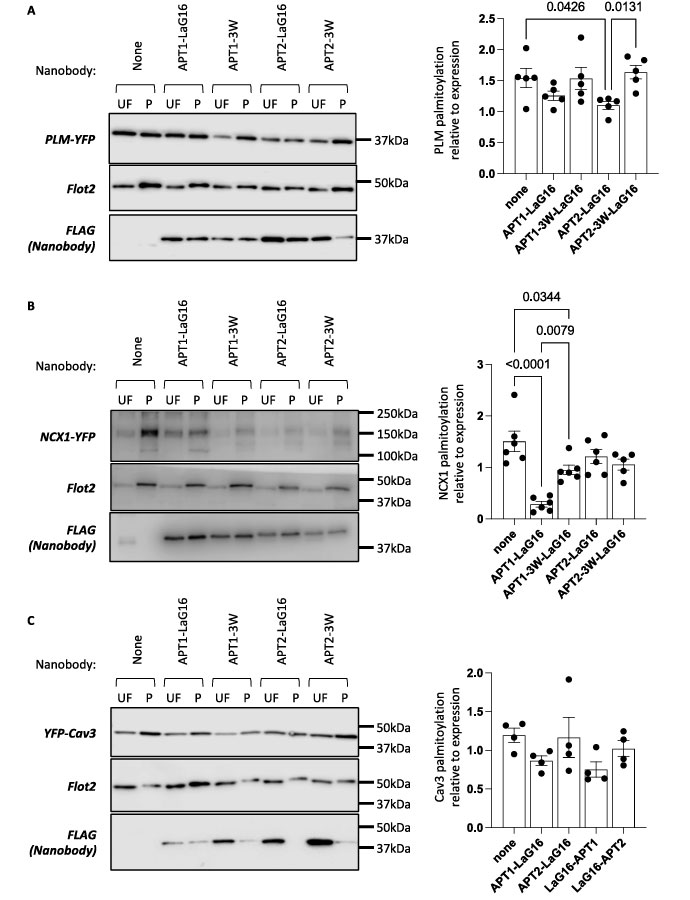
为进一步验证并揭示嵌合体对不同类型蛋白的作用与动态修饰的靶向规律,研究团队将LaG-16-APT融合体应用于磷酸受钠蛋白、钠钙交换体NCX1及小窝蛋白-3这三种带有YFP标签的膜蛋白。验证结果显示APT1-LaG-16仅能有效去棕榈酰化NCX1-YFP,而APT2-LaG-16仅能有效去棕榈酰化PLM-YFP;使用结合力弱的3W-LaG-16融合体时,去棕榈酰化效果显著减弱;而无论是APT1还是APT2融合体,都无法去除YFP-小窝蛋白-3的棕榈酰化。
验证结果表明,纳米抗体嵌合体可广泛应用于靶向去棕榈酰化动态棕榈酰化的膜蛋白,其效果取决于特定的硫酯酶-底物组合。然而,该技术无法作用于组成型或不可逆棕榈酰化的蛋白,如小窝蛋白-3。
图3:嵌合体对膜蛋白棕榈酰化的影响
化学遗传控制达成时空调控
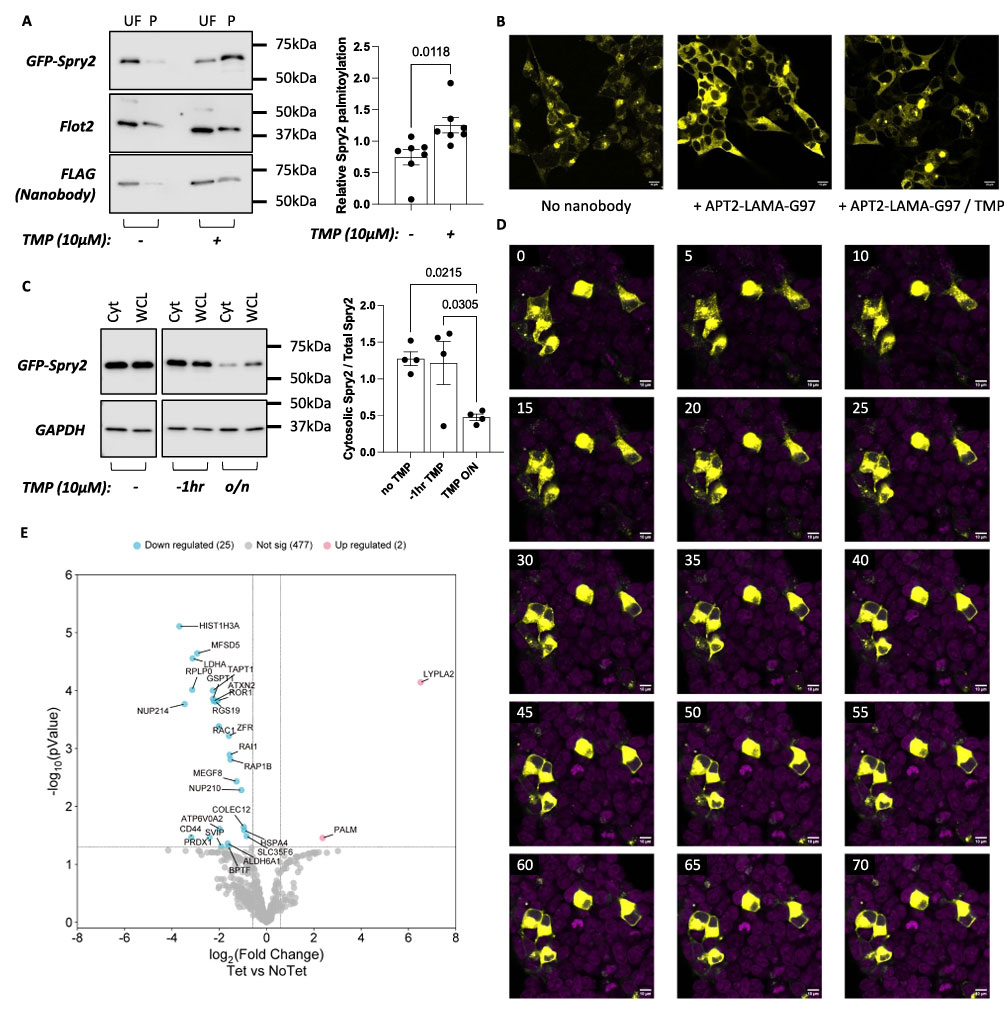
为了实现时空调控,研究团队引入了配体调节抗体片段技术。他们将环状置换的细菌二氢叶酸还原酶插入抗GFP纳米抗体LaG-16的CDR3环中,构建成LAMA。正常情况下,LAMA能结合GFP。当同时存在DHFR的辅因子NADPH和抑制剂甲氧苄啶时,cpDHFR构象改变会迫使LAMA释放其目标蛋白。
结果显示,将cpDHFR插入CDR3的不同位置,构建了两种APT2-LAMA嵌合体。在HEK293细胞中,加入TMP显著减弱了G97-LAMA与YFP-α1C-II的结合,并完全阻断了G97-LAMA的去棕榈酰化活性,TMP对F98-LAMA的结合和去棕榈酰化活性影响较小。
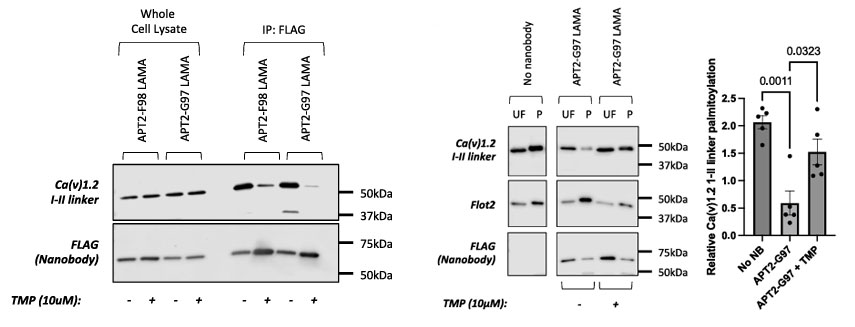
图4:靶向蛋白质棕榈酰化的配体调控抗体片段
研究团队将APT2-G97-LAMA应用于模型蛋白eGFP-Spry2后发现,无TMP时,嵌合体有效去棕榈酰化Spry2,其定位变为弥散胞质型;有TMP时,去棕榈酰化被阻断,Spry2保持膜定位。撤除TMP后,1小时内即可观察到Spry2从膜结构快速释放到胞质。全局蛋白质组学分析表明,诱导表达APT2-G97-LAMA主要增加了嵌合体自身LYPLA2(APT2)的表达。棕榈酰化蛋白质组分析显示,诱导表达嵌合体后,仅5%的棕榈酰化蛋白丰度降低,2个蛋白丰度增加,表明脱靶效应有限。
图5:LAMA介导的去棕榈酰化对GFP-Spry2的影响
结果证明,采用LAMA+TMP的化学遗传学方法成功实现了对纳米抗体嵌合体结合和去棕榈酰化活性的快速、可逆的时间控制。该嵌合体在细胞中表达具有高度特异性,对整体蛋白质组影响极小,对棕榈酰化蛋白质组的重塑也相当有限。
靶向Ca(v)1.2,破解心律失常难题
由于Ca(v)1.2钙通道的棕榈酰化异常与心律失常密切相关,研究团队将抗Ca(v)1.2-β亚基的纳米抗体F3与APT2融合,在干细胞衍生的心肌细胞(iPSC-CMs)中验证其功能。
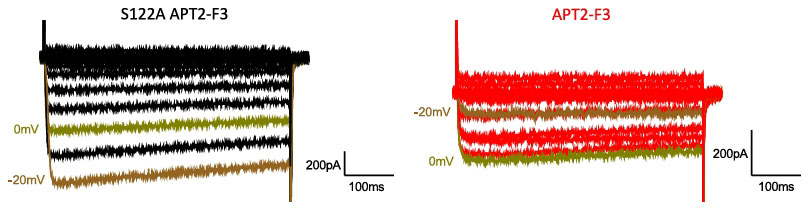
研究发现,APT2-F3能结合并去棕榈酰化Ca(v)1.2 α1C亚基,且依赖β亚基的存在。在表达Ca(v)1.2全通道的细胞中,APT2-F3使通道激活曲线V50显著右移约-10 mV,模拟了棕榈酰化位点突变的效果。在人诱导多能干细胞来源的心肌细胞单层中,表达APT2-F3或其失活突变体S122A-APT2-F3的基础动作电位无差异。
图6:APT2-F3活性细胞(红色) APD 延长程度显著低于失活细胞(黑色)
而在使用HERG通道阻滞剂多非利特延长动作电位时程(APD)并诱发早后除极后发现,表达APT2-F3的心肌细胞,其APD延长程度显著小于表达失活突变体的细胞,其发生EAD的频率显著降低。
结果证明,利用靶向β亚基的纳米抗体F3递送APT2,成功实现了对Ca(v)1.2 α1C亚基的特异性去棕榈酰化。这不仅精确调节了通道的电压依赖性,更重要的是,证明了该策略在心血管领域的治疗潜力。
纳米抗体技术的积极效应与治疗前景的展望
这项研究开发的纳米抗体-硫酯酶嵌合体技术具有里程碑式的意义,它展现了前所未有的特异性,实现了动态修饰循环如何影响蛋白质功能的动态可逆操控,并揭示了酶学新规则,为发现和验证这些规则提供了新途径。
在精准治疗策略,尤其在心血管领域具有良好的应用前景。这项研究直接证明了靶向Ca(v)1.2去棕榈酰化能有效调节通道功能,抑制早后除极,降低心律失常易感性,为开发治疗致命性室性心律失常的全新策略提供了概念验证和坚实基础。不仅于此,该技术可拓展至癌症(如靶向Ras蛋白异常棕榈酰化)、神经疾病(如调控亨廷顿蛋白或阿尔茨海默病相关蛋白Aβ/TAU的棕榈酰化)、代谢性疾病与抗病毒等临床治疗策略中,为精准医疗领域提供了一份有效的武器。