由于YAP缺乏传统小分子药物可结合的口袋结构,长期被归为“不可成药”靶点。而近年兴起的蛋白水解靶向嵌合体(PROTAC)技术为靶向“不可成药”靶点提供了新思路,然而传统小分子PROTAC在靶向YAP时仍面临亲和力有限、肿瘤组织穿透性差等问题。因此,开发能精准靶向YAP的治疗手段,成为突破YAP依赖性癌症治疗瓶颈的关键。由我国多所研究机构联合发表于《Nature Communications》的一项研究开发了一种由纳米抗体介导的bioPROTAC降解技术,可特异性降解肿瘤中的YAP蛋白,为YAP依赖性癌症提供了可行的治疗新策略。
YAP纳米抗体的筛选与表征
研究团队首先以截短的人YAP蛋白为抗原,构建YAP-GST融合蛋白并在大肠杆菌中纯化获得目标蛋白。随后利用纳米抗体噬菌体文库开展三轮生物淘选,在排除仅结合GST的非特异性克隆后,获得12个具有独特CDR3序列的抗YAP纳米抗体,经ELISA实验显示,12个纳米抗体均能特异性结合内源性YAP蛋白,且不与GST结合,其中E3、E4、E8亲和力最优。
通过HA pull-down实验和SPR测试分析证实,这些纳米抗体能够与内源性YAP蛋白特异性结合,且E8纳米抗体明确靶向YAP的 WW2结构域,这一精准结合位点为后续特异性降解提供了分子基础。在YAP基因敲除的MKN45胃癌细胞模型中,E8纳米抗体未表现出非特异性结合,进一步验证了其靶向专一性。
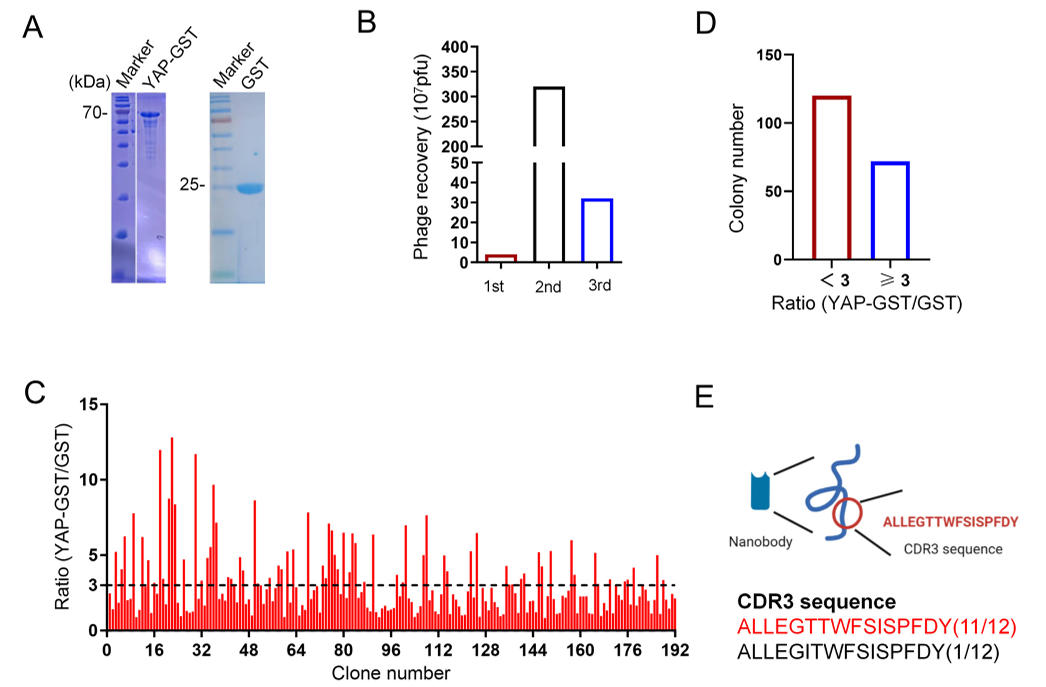
图1:筛选靶向YAP蛋白的纳米抗体
靶向YAP的bioPROTAC构建与活性验证
基于筛选获得的优质纳米抗体,研究团队将E8纳米抗体与E3泛素连接酶RNF4的RING结构域融合,成功构建YAP-bioPROTAC分子(E8-2RNF4)。该分子通过纳米抗体结构域结合YAP,同时通过RING结构域招募泛素化系统,形成“靶蛋白-降解剂-E3连接酶” 三元复合物,启动YAP的泛素-蛋白酶体降解通路。

图2:YAP特异性纳米抗体的纯化及亲和力测定
在多西环素诱导表达系统中,E8-2RNF4在葡萄膜黑色素瘤、间皮瘤、胃癌等多种YAP依赖性癌细胞系中均表现出强效降解活性,YAP蛋白降解率超过80%。时间进程实验显示,YAP降解的半衰期在 16.8-36.8小时之间,且这一降解过程可被蛋白酶体抑制剂MG132完全阻断,明确证实其通过泛素-蛋白酶体途径发挥作用。

图3:YAP-bioPROTAC诱导YAP降解并抑制肿瘤
功能学实验表明,E8-2RNF4能显著抑制肿瘤细胞增殖,诱导 Annexin V阳性凋亡细胞增加,并有效阻断肿瘤细胞迁移。同时,qPCR检测显示YAP下游靶基因CTGF、CYR61的表达水平显著下调,证实降解剂成功阻断了YAP的转录激活功能。
体内抗肿瘤活性与递送系统优化
在斑马鱼胚胎模型中,E8-2RNF4处理显著抑制了葡萄膜黑色素瘤细胞的扩散,证实其在活体环境中的抗转移活性。在小鼠异种移植瘤模型中,通过多西环素诱导E8-2RNF4表达,能够显著抑制MDA-MB-231乳腺癌、MSTO-211H间皮瘤和IM95胃癌等肿瘤的生长,治疗组肿瘤体积较对照组缩小60%-75%,荷瘤小鼠生存期延长40%以上。
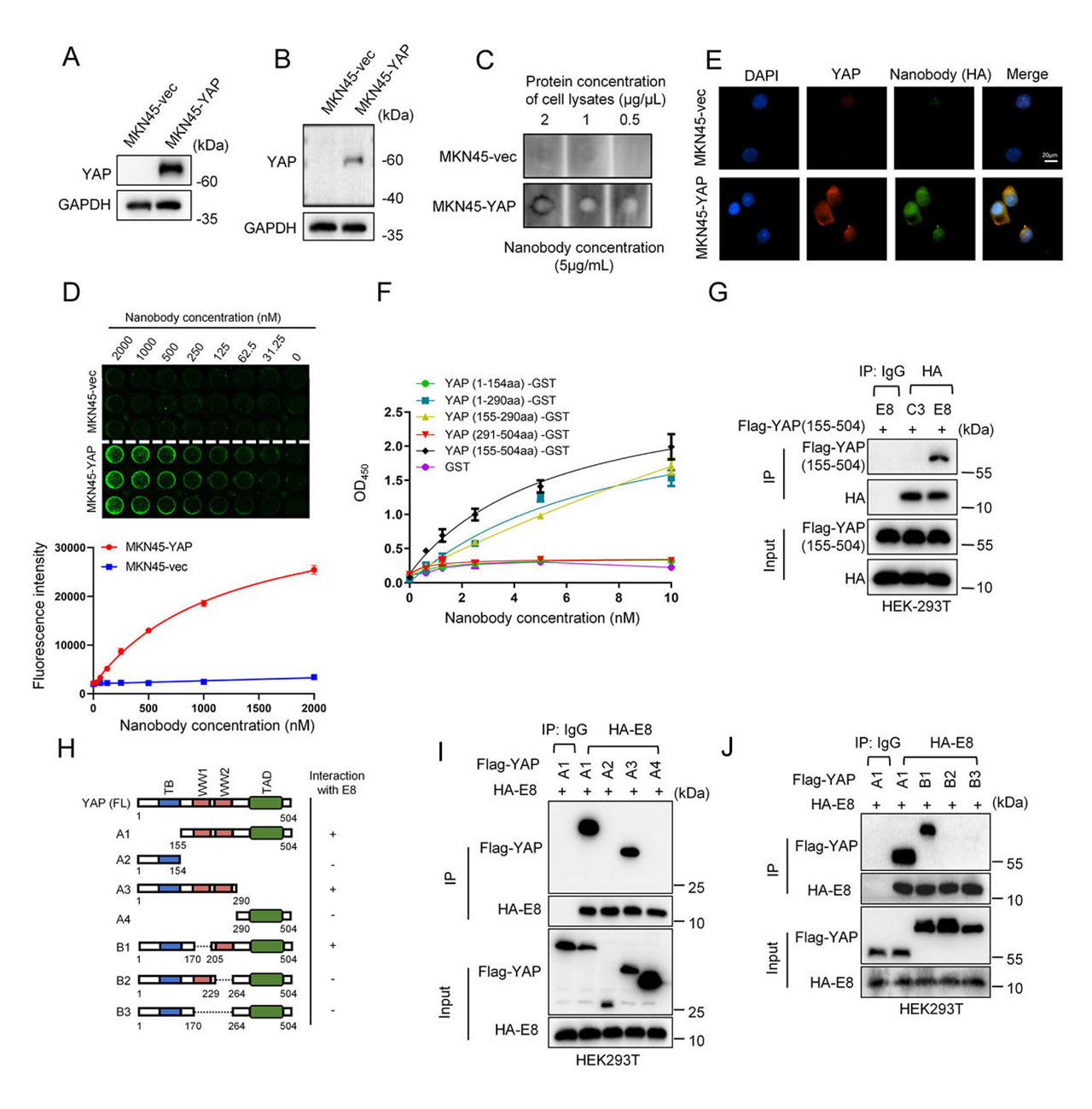
图4:E8纳米抗体与YAP的特异性结合
免疫组化分析显示,治疗组肿瘤组织中YAP蛋白水平显著降低,增殖标志物Ki-67的阳性表达率下降50%,进一步证实YAP降解与肿瘤生长抑制的直接关联。为解决体内递送难题,研究团队开发了基于聚乙烯亚胺/聚谷氨酸(PEI/PGA)的纳米颗粒递送系统,该载体能高效递送YAP-bioPROTAC编码质粒,在肿瘤组织中实现特异性表达。同时,腺相关病毒(AAV9)载体介导的递送策略也显示出良好治疗效果,两种递送方式均未导致小鼠体重明显下降或肝肾功能异常,展现出良好的生物安全性。
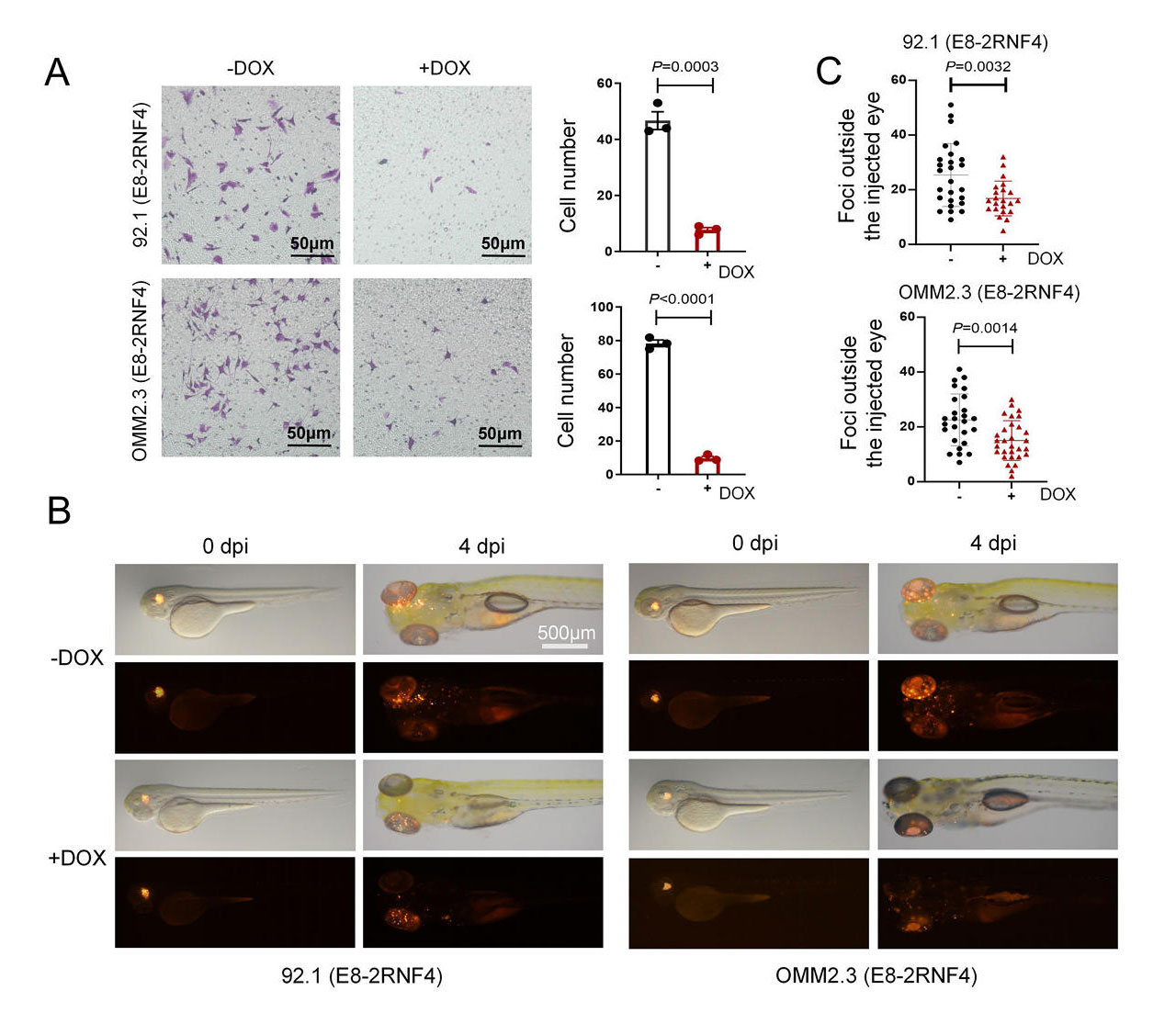
图5:YAP-bioPROTAC在体内外的肿瘤迁移抑制活性
纳米抗体在研究中的优势
该研究通过纳米抗体介导的YAP靶向降解技术,成功突破了“不可成药”靶点的研究瓶颈,为肿瘤精准治疗带来了创新性的突破。纳米抗体的精准靶向能力、高亲和力、高特异性、强穿透力和易修饰性使其成为靶向降解系统的核心组件,同时其免疫原性极低、结构稳定,可大规模表达,生产成本低,为临床转化提供便利,其研究成果在多种肿瘤模型中的显著疗效和良好安全性。
武汉纳博生命科技有限公司是由武汉产业创新发展研究院牵头成立建设的纳米抗体产业平台。其总部位于武汉东湖新技术开发区武创院本部大楼,在武汉生物城精准医疗产业基地拥有占地面积达1400㎡的自主实验室,并在武汉左岭与黄冈团风分别建立了符合实验动物标准的羊驼实验基地与转运基地,目前基地在饲养的羊驼共600余头,可为科研机构及抗体药物研发企业提供“零免疫背景”保障的羊驼免疫服务。
纳博生命专注于纳米抗体开发、改造与应用,致力于构建产、学、研一体化的实验公共服务平台。现拥有从抗原制备(多肽、蛋白及RNA),到抗体发现和抗体工程,再到生物学功能验证/筛选的全链路技术平台。其中RNA抗原包括针对羊驼进行RNA结构和序列优化的RNA;抗体发现与抗体工程服务采用噬菌体展示、RNA以及哺乳动物细胞展示在内的多种技术路线。通过多平台的交叉互补为药企及科研院所提供灵活的抗体发现及改造服务,助力药物试剂的研发。
联系方式:400-822-9180 丨 联系邮箱:marketingdept@nanobodylife.com