由法国马赛大学、瑞士伯尔尼大学、苏黎世大学等多所顶尖科研机构联合开展的一项研究成功筛选出5种特异性结合犬PD-L1的纳米抗体,其中4种能有效阻断PD-1/PD-L1相互作用。通过构建双特异性、多价态和Fc融合的纳米抗体复合物,研究人员显著提升了其阻断效能和免疫激活能力。最佳构建体在体外实验中显示出皮摩尔级别的抑制活性,并能有效诱导抗体依赖性细胞毒性(ADCC)和干扰素γ(IFNγ)释放,为犬类癌症的免疫治疗提供了强有力的候选药物。这篇名为“Nanobody-based canine PD-L1-targeting immune checkpoint inhibitors for cancer therapy in dogs”的研究于2025年9月18日发表在《Molecular Therapy: Oncology》期刊。
抗cPD-L1纳米抗体的筛选与鉴定
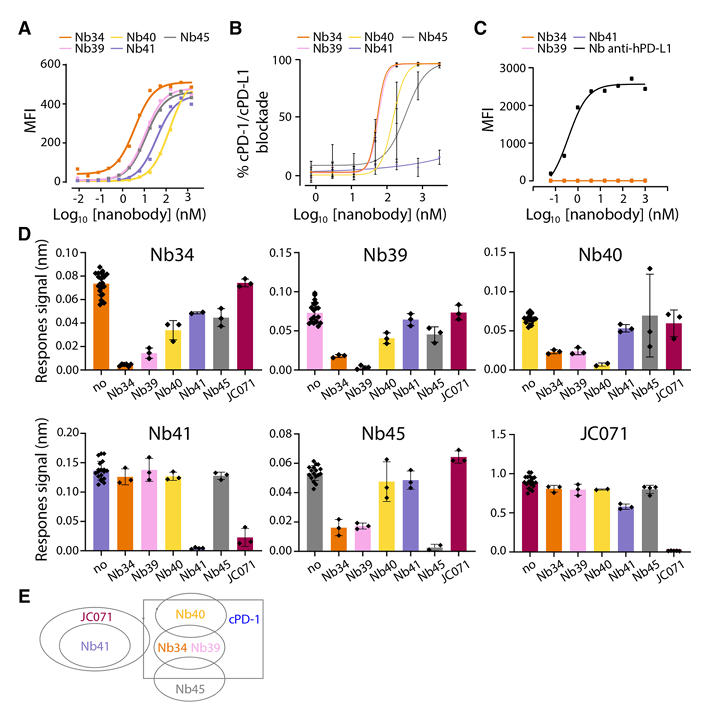
研究团队首先通过可溶性犬PD-L1胞外域免疫羊驼后利用噬菌体展示技术经过多轮淘选,成功分离出5个纳米抗体克隆(Nb34、Nb39、Nb40、Nb41、Nb45)。通过生物层干涉法(BLI)和流式细胞术分析发现,这些纳米抗体既能结合可溶性重组cPD-L1,也能结合细胞膜锚定的cPD-L1。
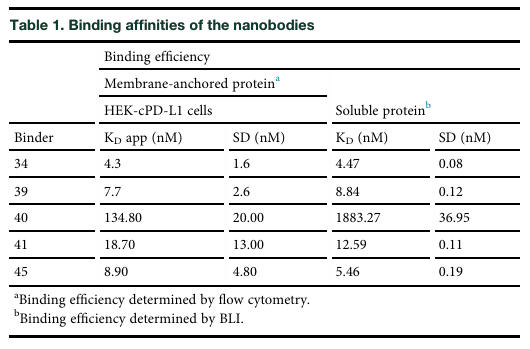
从结合亲和力来看,这些纳米抗体与重组cPD-L1的结合亲和力在2μM至5nM之间,与表达cPD-L1细胞的表观亲和力在150nM至4nM之间,其中Nb34表现出最强的结合效力(见表1)。竞争ELISA实验显示,除Nb41外,其余4种纳米抗体均能有效阻断cPD-1/cPD-L1相互作用,半数抑制浓度(IC₅₀)在340nM至53nM之间。同时,流式细胞术检测表明,这些纳米抗体均不与人PD-L1发生交叉反应,确保了其在犬类治疗中的特异性。
为明确纳米抗体在cPD-L1上的表位分布,研究团队通过BLI进行表位分箱实验。结果显示,Nb34和Nb39结合位点相近,对Nb40和Nb45的结合有一定阻碍,而Nb40和Nb45结合于非重叠表位。令人意外的是,已知能阻断cPD-1/cPD-L1相互作用的单克隆抗体JC071,仅与无法阻断该相互作用的Nb41竞争结合位点,推测JC071的阻断作用可能依赖空间位阻而非直接竞争PD-1结合表位。
图1:抗cPD-L1纳米抗体的表征
表1:纳米抗体的结合亲和力
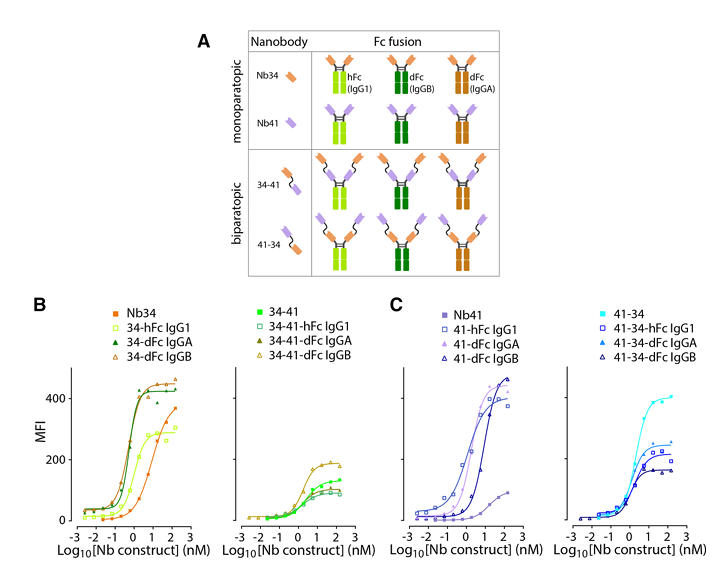
多价纳米抗体构建体的设计与制备
为提升纳米抗体的临床应用潜力,研究团队设计了多种多价构建体。选取结合效果好且结合于非重叠表位的Nb34和Nb41,通过柔性linker以两种方向(34-41和41-34)构建双特异性串联结构。同时,将这些纳米抗体与不同Fc结构域融合,包括具有效应功能的人IgG1和犬IgGB,以及无效应功能的犬IgGA,以增强分子价态、延长体内半衰期并探索Fc相关效应功能。
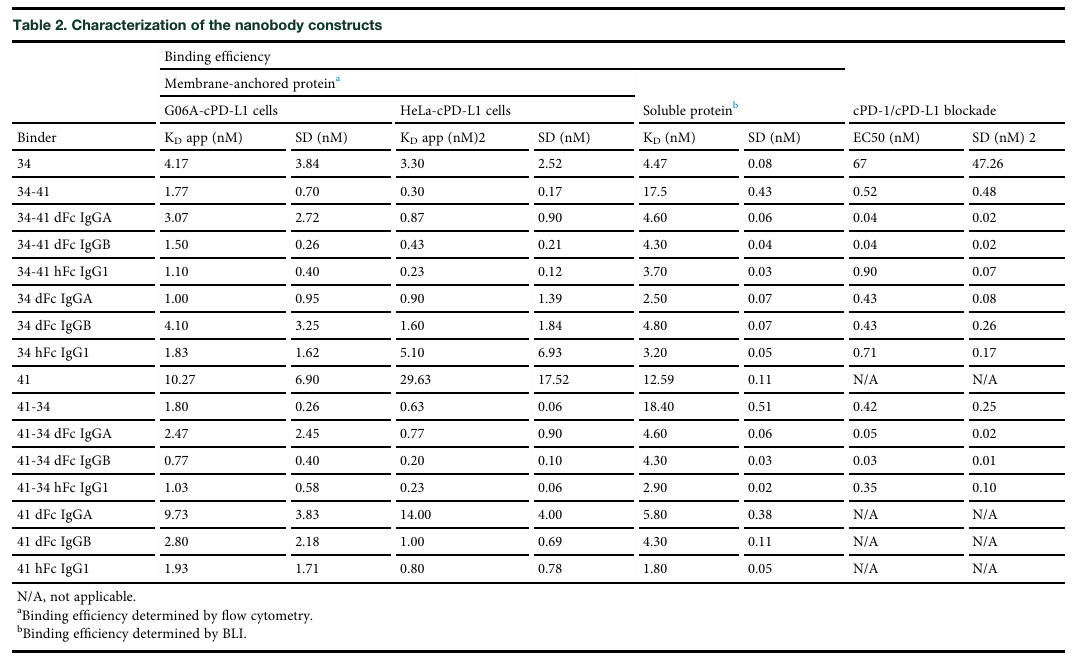
所有纳米抗体构建体均在哺乳动物细胞中表达,通过蛋白A亲和层析(携带Fc的构建体)或固定化金属亲和层析(无Fc的构建体)纯化,并通过SDS-PAGE和尺寸排阻色谱进行质量控制。BLI和流式细胞术检测表明,所有工程化分子均能有效结合cPD-L1,尽管与单价纳米抗体相比,结合亲和力未大幅提升,但多数构建体与膜锚定cPD-L1的亲和力提升超过5倍,结合效率多达到纳摩尔级(见表2)。
图2:纳米抗体构建体与膜锚定cPD-L1的结合
表2:纳米抗体构建体的表征
纳米抗体构建体对cPD-1/cPD-L1信号通路的阻断效果
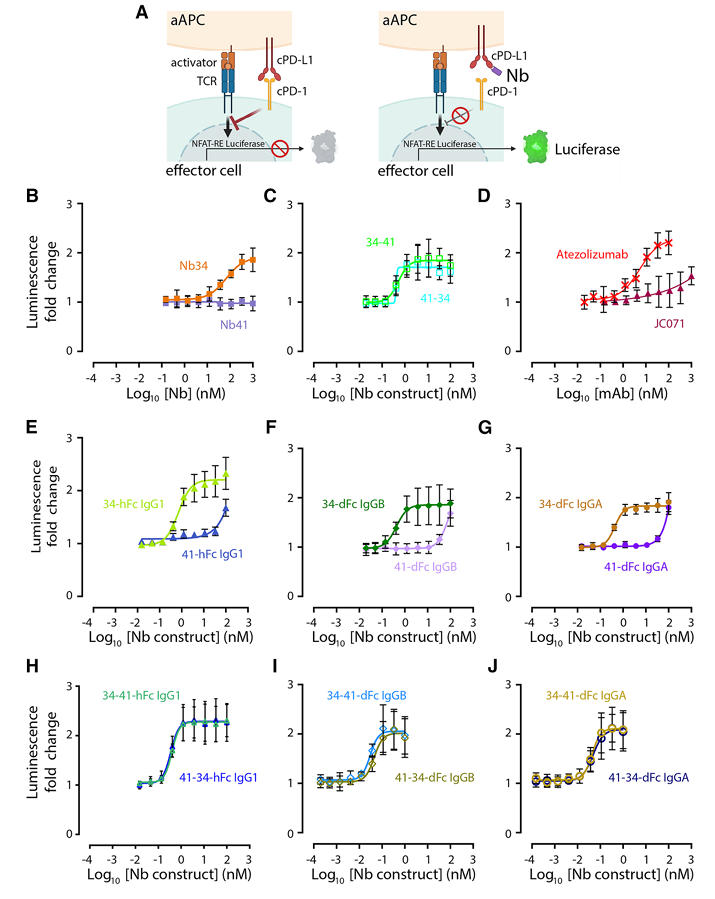
利用新构建的基于细胞的报告基因检测系统,研究团队评估了纳米抗体构建体对cPD-1/cPD-L1信号通路的阻断能力。该系统通过混合表达cPD-1的效应细胞和表达cPD-L1的人工抗原提呈细胞,检测NFAT启动子驱动的荧光素酶报告基因信号来反映信号通路阻断情况。
结果显示,除非阻断性单价Nb41外,所有纳米抗体构建体均能显著提高荧光素酶活性,表明其能有效阻断cPD-1/cPD-L1信号通路。值得注意的是,含Nb41的双特异性构建体阻断效果超过单独的Nb34,而Nb41-Fc和JC071仅在高浓度时轻微提升荧光素酶活性,进一步证实JC071可能通过空间位阻发挥作用。
更重要的是,二价构建体的半数有效浓度(EC₅₀)比单价纳米抗体降低约100倍,达到皮摩尔级,四价dFc分子(尤其是犬IgGB Fc结构域)的抑制效能比单价纳米抗体高约1000倍,比二价构建体高10倍,且部分四价构建体效果比阿替利珠单抗高约100倍(见表2),充分证明了多价纳米抗体构建体在阻断cPD-1/cPD-L1信号通路方面的卓越性能。
图3:纳米抗体构建体阻断cPD-L1/cPD-1相互作用的测定
纳米抗体构建体诱导ADCC效应的能力
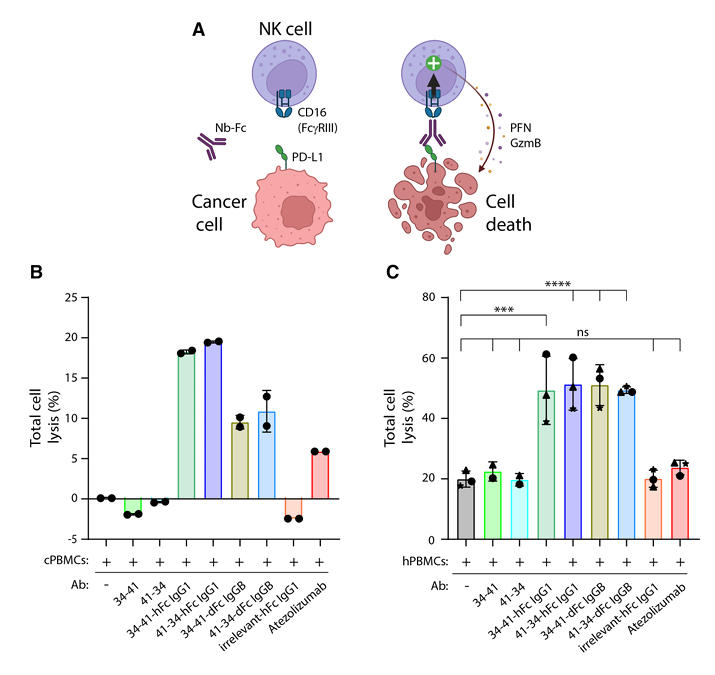
研究团队还探究了携带功能性Fc结构域的纳米抗体构建体诱导 ADCC效应的能力。将纯化的人自然杀伤(NK)细胞与表达cPD-L1的HeLa细胞共培养,并加入不同浓度的纳米抗体构建体。结果显示,携带人IgG1 Fc结构域的双特异性构建体能在低皮摩尔浓度下高效诱导ADCC;携带犬IgGB Fc结构域的构建体在高浓度(100nM)时也能诱导一定程度的ADCC。
在更贴近临床实际的实验条件下,将表达cPD-L1的犬G06A细胞与犬外周血单个核细胞(PBMCs)共培养,或表达cPD-L1的HeLa细胞与人类PBMCs共培养,通过实时细胞分析(RTCA)监测细胞裂解情况。结果表明,携带人IgG1或犬IgGB Fc结构域的纳米抗体构建体均能显著诱导ADCC,且在犬细胞体系中,阿替利珠单抗仅诱导微弱的细胞死亡,进一步验证了所构建纳米抗体在犬类癌症治疗中的优势。
图4:纳米抗体构建体对ADCC的触发作用
纳米抗体构建体对犬T细胞IFNγ释放的影响
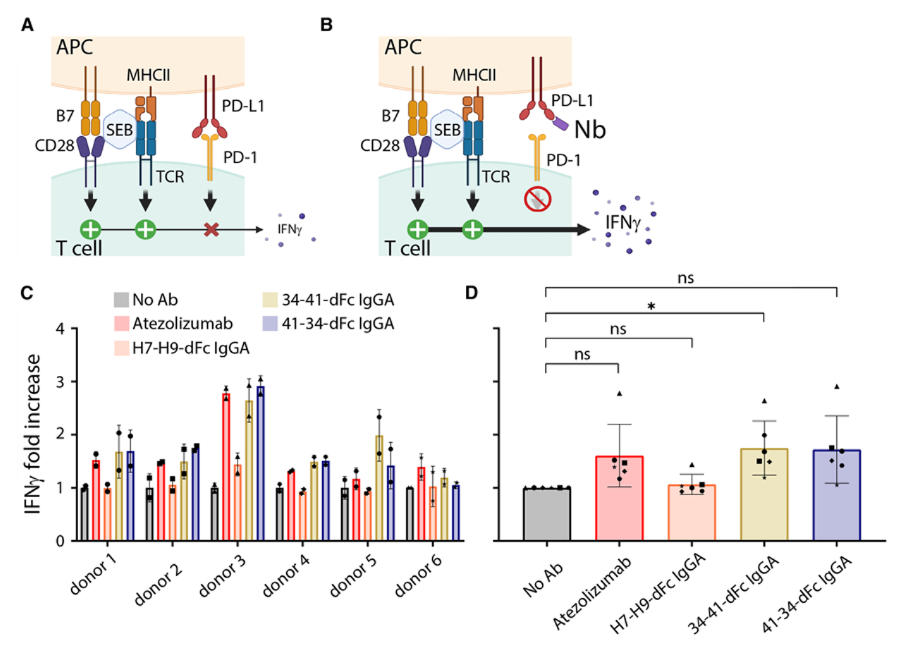
为评估纳米抗体构建体对犬T细胞活化的影响,研究团队利用葡萄球菌肠毒素B(SEB)刺激犬PBMCs,检测IFNγ的释放情况。SEB可同时结合抗原提呈细胞的MHC II类分子和T细胞的TCR复合物,激活大量T细胞并释放IFNγ,而cPD-1/cPD-L1信号通路会调节这一过程。
实验结果显示,阿替利珠单抗能轻微提高所有供体PBMC的IFNγ产量,而携带犬Fc沉默亚型(IgGA)的两种双特异性纳米抗体构建体在多数供体中表现出更强的活性,其中34-41-dFc IgGA构建体使 IFNγ产量显著增加,证明这些纳米抗体构建体可有效增强犬类T细胞的免疫应答,为其在犬类癌症免疫治疗中的应用提供了进一步支持。
图5:抗cPD-L1双特异性纳米抗体构建体处理后PBMCs的IFNγ产生
研究应用领域与行业价值
此项研究开发的纳米抗体不仅可以直接应用于犬类癌症治疗,填补犬类癌症免疫治疗市场空白,还可改善癌症研究模型开发与免疫治疗机制的研究。
犬类自发性癌症与人类癌症在病理特征、免疫微环境等方面具有高度相似性,且犬类与人类生活环境相同,其癌症发展过程更能模拟人类癌症。该研究中开发的纳米抗体为研究cPD-1/cPD-L1信号通路的调控机制、免疫检查点阻断疗法的作用原理以及ADCC效应在癌症免疫治疗中的作用提供了理想的工具。通过这些工具,科研人员可深入探索犬类乃至人类免疫系统与肿瘤之间的相互作用,揭示免疫治疗耐药的机制,为开发新型免疫治疗策略提供理论依据。可用于构建更精准的犬类癌症研究模型,为人类癌症免疫治疗研究提供更可靠的动物实验数据,加速人类癌症治疗药物的研发进程。

武汉纳博生命科技有限公司是由武汉产业创新发展研究院牵头成立建设的纳米抗体产业平台。其总部位于武汉东湖新技术开发区武创院本部大楼,在武汉生物城精准医疗产业基地拥有占地面积达1400㎡的自主实验室,并在武汉左岭与黄冈团风分别建立了符合实验动物标准的羊驼实验基地与转运基地,目前基地在饲养的羊驼共600余头,可为科研机构及抗体药物研发企业提供“零免疫背景”保障的羊驼免疫服务。
纳博生命专注于纳米抗体开发、改造与应用,致力于构建产、学、研一体化的实验公共服务平台。现拥有从抗原制备(多肽、蛋白及RNA),到抗体发现和抗体工程,再到生物学功能验证/筛选的全链路技术平台。其中RNA抗原包括针对羊驼进行RNA结构和序列优化的RNA;抗体发现与抗体工程服务采用噬菌体展示、RNA以及哺乳动物细胞展示在内的多种技术路线。通过多平台的交叉互补为药企及科研院所提供灵活的抗体发现及改造服务,助力药物试剂的研发。
除纳米抗体天然文库外,纳博生命科技还推出了现货免疫库,帮助客户快速筛选符合需求的抗体分子。
联系方式:400-822-9180 丨 联系邮箱:marketingdept@nanobodylife.com