CD19靶点的核心应用领域
由于CD19几乎只在B细胞谱系表达,且它与抗体结合后容易被细胞内吞进入细胞内部,因此CD19成为了B细胞相关恶性肿瘤和B细胞驱动的自身免疫性疾病的理想靶点。
针对CD19的成药研究以B细胞相关恶性肿瘤为核心领域,覆盖急性B淋巴细胞白血病(B‑ALL)、弥漫性大B细胞淋巴瘤(DLBCL)、原发性纵隔大B细胞淋巴瘤(PMBCL)、慢性淋巴细胞白血病(CLL)、套细胞淋巴瘤(MCL)等,主要用于该领域疾病的靶向治疗与微小残留病(MRD)监测;在B细胞驱动的自身免疫性疾病领域则覆盖了系统性红斑狼疮(SLE)、视神经脊髓炎谱系疾病(NMOSD)、多发性硬化(MS)等,通过清除异常B细胞、抑制自身抗体产生实现治疗。
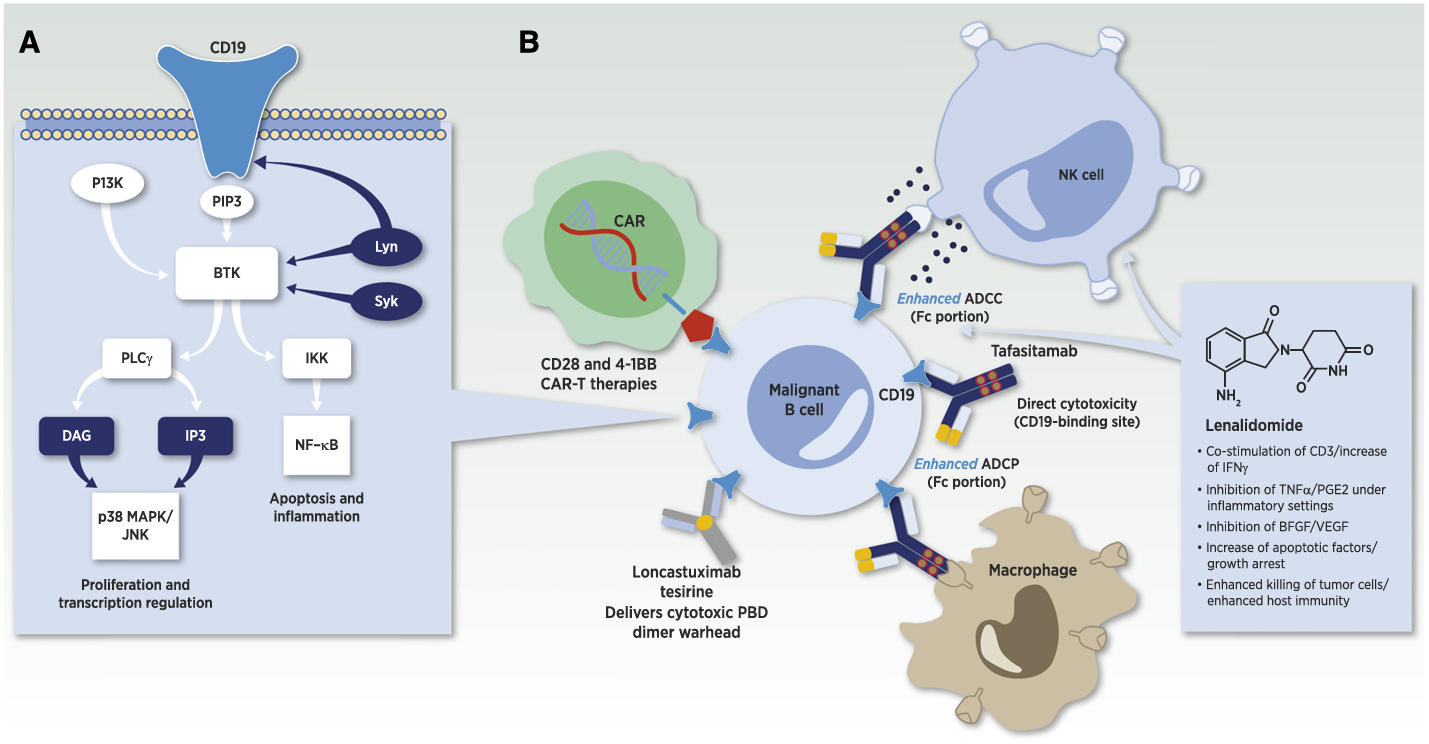
CD19信号通路和CD19靶向治疗策略[1]
CD19药物研发现状与在研管线进展
目前,全球范围内已有多款获批上市的CD19靶点药物,主要集中在B细胞淋巴瘤、B淋巴细胞白血病等适应症,而技术路径则主要集中在CAR-T领域。其他已进入临床的药物研究路径与这些大抵相同,但仍有个别创新的成药策略值得关注。
CAR‑T/NK细胞疗法
-
自体细胞疗法:如已上市的替沙仑赛、阿基仑赛、利基奥仑赛、布瑞基奥仑赛等药品均需采集患者自体T细胞,经基因编辑表达CD19靶向CAR精准识别并持续杀伤CD19+肿瘤细胞;
-
异体细胞疗法:与自体细胞疗法不同的是,异体细胞疗法采用健康供体细胞进行改造,可提前制备,降低了生产成本与制备周期,如Cellectis公司研发的UCART19。深圳恩瑞凯诺研发的KN5501是一款适应症为SLE的CD19靶点CAR-NK产品,由上海长海医院开展的临床试验结果显示67%的患者已实现完全Doris缓解,无复发病例;
-
双靶点CAR‑T:双靶点CAR细胞疗法旨在弥补单靶点治疗可能出现的抗原丢失,降低肿瘤细胞逃逸并减少耐药性。如亘喜生物开发靶向CD19和BCMA的GC012F,及强生研发靶向CD19和CD20的JNJ‑4496均已进入临床I期;
ADC药物
-
Loncastuximab是一款已上市的CD19靶点ADC药物,在识别并结合CD19后受内吞作用进入肿瘤细胞内部,而后被降解,同时释放PBD二聚体毒素进入细胞核与DNA强力交联,从而破坏DNA复制和转录过程,诱导肿瘤细胞死亡;由Iksuda Therapeutics研发的IKS03作用机制与之相同;由ImmunoGen研发的SAR3419作用机制则是在进入细胞内部后释放DM4毒素来破坏细胞微管组装,导致细胞周期停滞和死亡;
抗体药物
-
单抗:坦昔妥单抗是用于血液瘤的CD19靶向单抗药物,除直接靶向CD19促进肿瘤细胞凋亡以外,其Fc段可与NK细胞、巨噬细胞、树突状细胞结合,进一步促进肿瘤细胞被消除;另一款已上市的CD19靶向药物——伊奈利珠单抗的适应症则是视神经脊髓炎谱系障碍(NMOSD),该药物通过工程化改造后,能更高亲和力地与NK细胞等免疫效应细胞表面的Fcγ受体结合使之激活并释放穿孔素、颗粒酶等毒性颗粒导致CD19+细胞凋亡;
-
双/多抗:贝林妥欧单抗是用于白血病治疗的靶向CD3和CD19的双抗药物,核心机制是将CD19+肿瘤细胞与表达CD3的T细胞紧密结合,形成免疫突触,直接杀伤肿瘤细胞,无需抗原递呈;Obexelimab是一款靶向CD19和FcγRIIB的双抗药物,主要为B细胞相关的自身免疫性疾病,其两段分别与靶点结合后,FcγRIIB会向B细胞内部传导信号阻断BCR的信号通路,从而抑制B细胞的过度活化、增殖以及向浆细胞的分化;
纳米抗体在CD19药物研发中的优势
临床前研究已证实纳米抗体的高特异性与高亲和力可有效清除肿瘤细胞,且免疫原性与耐药风险更低。近年,已有众多以纳米抗体为核心设计思路的药物研发,纳米抗体的极小分子体积使其拥有超高组织穿透性和靶向能力,可识别传统抗体无法识别的隐蔽表位,减少脱靶效应,同时在ADC成药研究中也可具备更强的内吞活性;易于工程化改造的能力可以让纳米抗体轻松串联多个结构域形成双抗或多抗的形式,降低CD19抗原逃逸带来的复发和耐药性风险;而强理化稳定性的能力让纳米抗体更好的适应环境,其高效表达的能力使其可以大规模快速生产,极大程度上降低生产、运输及保存成本。

纳博生命拥有的pDual噬菌体展示技术,能够在传统噬菌体展示的高效开发的基础上,无缝连接哺乳动物细胞高效生产,大大提高筛除问题分子的效率;而NabLib®哺乳动物细胞展示技术,不仅可以提升筛选分子的可开发性,还可以灵活地选择抗体的筛选构型,为下游抗体分子的应用和检测提供更好的保障。
同时,纳博生命推出CD19现货免疫文库。在完成羊驼免疫后,我们采集羊驼全血,分离PBMC以细胞库的形式冻存,客户可跳过冗长的免疫周期,直接进入筛选流程,大大节约抗体分子开发时间。通过定制化的筛选服务,获取最符合应用需求的多个抗体分子。